Materi Belajar
Sifat Koligatif : Sifat Koligatif pada Larutan, Materi Belajar Kimia Kelas 12
Sifat koligatif pada larutan akan dibahas pada materi belajar kimia Kelas 12 berikut ini.
Penulis: Rizky Aisyah |
TRIBUN-MEDAN.com.MEDAN – Sifat koligatif pada larutan akan dibahas pada materi belajar kimia Kelas 12 berikut ini.
Pengertian Sifat Koligatif Larutan
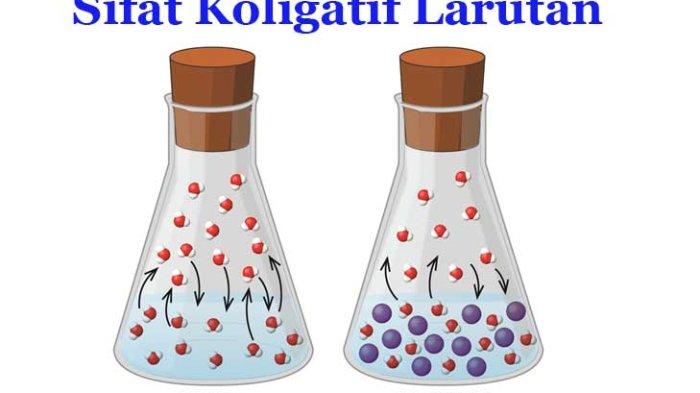
Sifat koligatif larutan adalah sifat larutan yang hanya dipengaruhi oleh jumlah partikel zat terlarut. Oleh karena itu, semakin banyak zat terlarut, semakin besar sifat kohesifnya.
Misalnya, Anda akan melarutkan gula dalam berbagai jumlah air panas seperti ini. Jadi, inilah kisah tentang dua gelas larutan gula. Di gelas pertama, larutkan 3 sendok teh gula dalam 500 ml air. Sedangkan di gelas kedua, larutkan 5 sendok teh gula pasir dengan jumlah air yang sama (500 ml). Karena gula adalah zat terlarut dan jumlah gelas kedua lebih besar, sifat kohesif larutan gelas kedua akan lebih besar daripada larutan gelas pertama.
Apakah Anda mengerti apa artinya itu?
Suatu larutan memiliki empat sifat kolektif: penurunan tekanan uap (ΔP), penurunan titik beku (ΔTf), peningkatan titik didih (ΔTb), dan tekanan osmotik (π).
Mengapa empat set simbol properti dalam solusi berbeda? Jadi apa arti setiap simbol? Delapan! Tenang teman-teman. Anda benar-benar akan memecahkan teka-teki itu! Namun sebelum itu, Anda perlu memahami konsep awal properti bersama dari suatu solusi. Ada tiga jenis larutan: larutan, larutan elektrolit, dan non-elektrolit.
Larutan elektrolit dan non-elektrolit
Nah, awalnya kamu sudah tahu apa solusinya. Maka Anda sudah mengetahui tentang sifat gabungan dan berbagai jenis solusi juga. Sekarang mari kita bahas perbedaan antara larutan elektrolit dan non-elektrolit!
Tergantung pada konduktivitas listrik, solusi dibagi menjadi dua jenis. Ada larutan elektrolit dan non-elektrolit. Jadi apa bedanya?
Larutan elektrolit adalah larutan yang mampu menghantarkan arus listrik. bagaimana itu? Hal ini dikarenakan larutan elektrolit dapat menghasilkan ion-ion yang bergerak bebas di dalam larutan. Contohnya adalah larutan garam (NaCl). Perhatikan peristiwa kimia di bawah ini!
NaCl(s) + H2O(l) → Na+(aq) + Cl-(aq)
Dari reaksi di atas terlihat bahwa bila senyawa NaCl dilarutkan dalam air akan terbentuk ion Na+ dan ion Cl-. Jadi kita dapat melihat bahwa jumlah ion terlarut adalah 2 ion.
Di sisi lain, larutan non-elektrolit melakukan sebaliknya. Larutan non-elektrolit tidak dapat menghantarkan listrik karena molekul terlarut tidak terionisasi dalam larutan. Oleh karena itu, tidak ada beda potensial yang terbentuk pada larutan, sehingga tidak ada aliran listrik. Contoh larutan non-elektrolit adalah larutan gula seperti glukosa, sukrosa, dan maltosa; larutan urea (CON2H4); dan larutan alkohol seperti metanol, etanol, dan propanol.
(cr30/tribun-medan.com)
Pengertian Sifat Koligatif Larutan
Larutan elektrolit
non-elektrolit
sifat larutan
Materi Belajar
Materi Belajar Kimia
Tribun Medan
| Fungsi dan Efek Rumah Kaca Bagi Kehidupan Manusia, Materi Belajar Biologi Kelas 7 |

|
|---|
| Langkah-langkah Penulisan Karya Ilmiah, Materi Belajar Bahasa Indonesia Kelas 9 |

|
|---|
| Langkah-langkah Membuat Esai, Materi Belajar Bahasa Indonesia Kelas 12 |

|
|---|
| Mengenal Manfaat Minyak Bumi dalam Kehidupan Manusia, Materi Belajar Kimia Kelas 11 |

|
|---|
| Macam-macam Interaksi dalam Ekosistem, Materi Belajar Biologi Kelas 10 |

|
|---|








![[FULL] Pakar Sebut Gugatan Rp 125 T Gibran Bunuh Karier Wapres 2 Periode & Prabowo Tak Jadi Boneka](https://img.youtube.com/vi/92cstTp4mWs/mqdefault.jpg)





Isi komentar sepenuhnya adalah tanggung jawab pengguna dan diatur dalam UU ITE.